免疫共沉淀CoIP实验技术原理
细胞裂解后,孵育结合了抗体的珠子,诱饵蛋白通过其抗体结合到Beads上,同时诱饵蛋白的互作蛋白,也一起“共沉淀”到Beads上。洗涤掉未结合的蛋白后,再用洗脱液将互作蛋白复合物从Beads洗脱下来,便得到免疫共沉淀CoIP产物。CoIP产物既可用Western Blot检测已知蛋白,也可用质谱鉴定未知蛋白。
当没有合适的诱饵蛋白抗体时,可以通过表达融合了Flag标签的诱饵蛋白,利用Flag标签做免疫沉淀。即细胞过表达Flag-Bait,经裂解后与anti-Flag珠子孵育,诱饵融合蛋白与Beads结合,其互作蛋白“共沉淀”到Beads上,再经洗涤、洗脱后用WB或质谱检测。
 添加技术员微信沟通实验
添加技术员微信沟通实验
免疫共沉淀Co-IP实验详细步骤流程
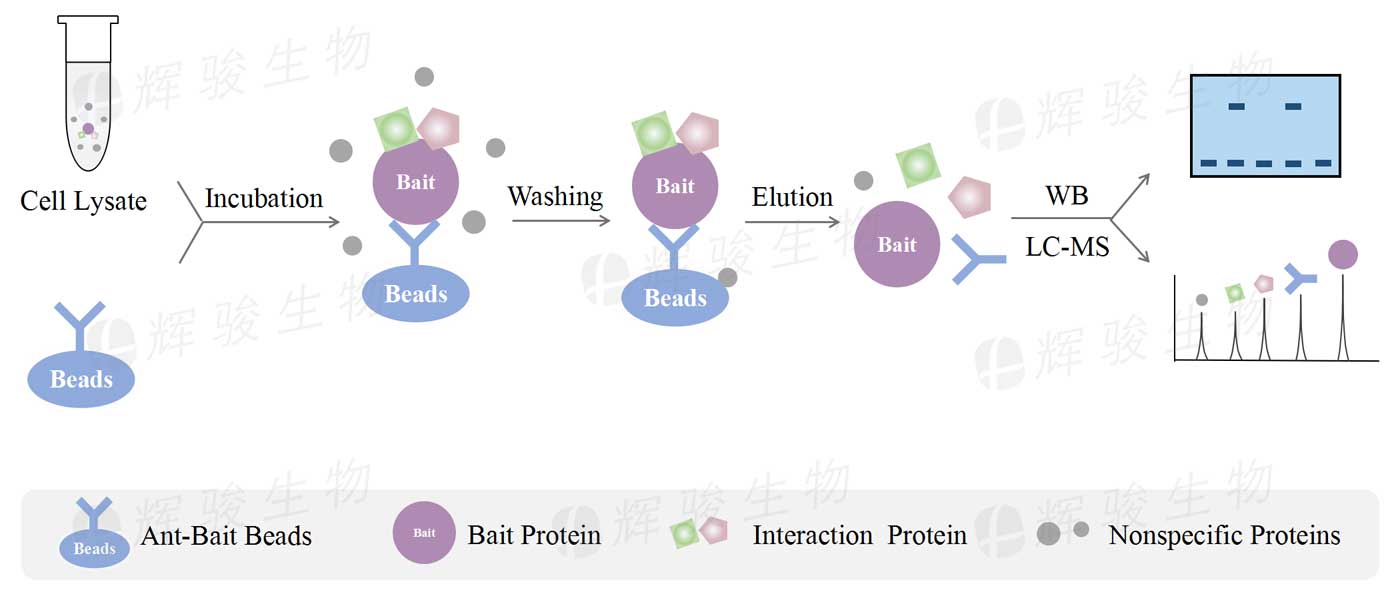
内源蛋白抗体免疫共沉淀CoIP实验步骤
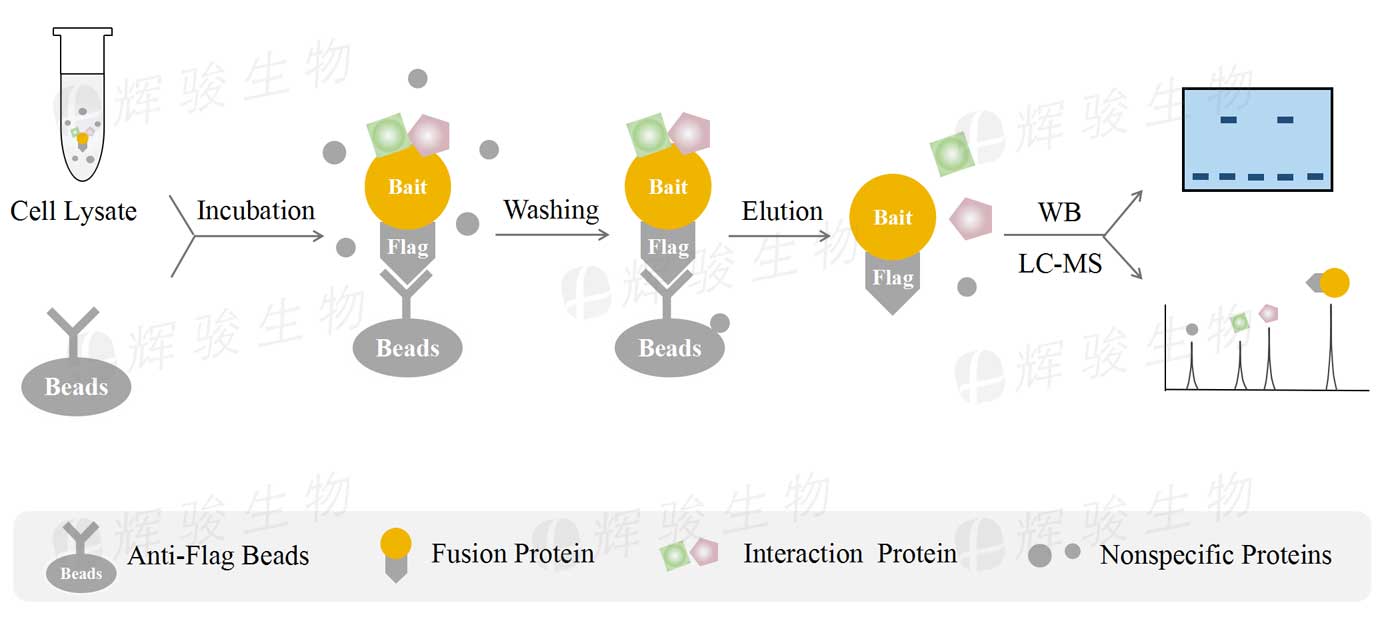
标签抗体免疫共沉淀CoIP实验流程
应用领域

Co-IP(免疫共沉淀)实验技术应用背景
蛋白质是几乎所有生命活动的直接效应分子,并且在行使功能的时候往往不是单打独斗的,蛋白质之间经常形成复合体,并且在工作过程中还会不断的更换相互作用的伙伴,从而行驶不同的功能。因此,研究蛋白质的相互作用成为研究蛋白质功能和作用机制的好为重要的环节之一。
常见的蛋白相互作用方法主要有免疫共沉淀(Co-IP)、pull down、酵母双杂交、荧光双分子互补(BiFC)、荧光共.等。
Co-IP技术采用目标蛋白的抗体捕获样本中的目标蛋白及其互作蛋白复合物,反应的是体内真实的生理结合,但是不能显示这些相互作用是直接还是间接的;另外合适的免疫共沉淀抗体是决定实验成功的关键,有些蛋白没有可用的IP抗体,无法进行内源性Co-IP实验;通过构建带标签的表达载体,使目标蛋白与标签融合表达,借助标签抗体可以完成Co-IP实验,但需要注意合适的转基因方法又是影响该方法成功的关键。
pull down技术将目标蛋白进行体外原核表达,使标签蛋白(GST或His等)与目标蛋白融合表达,借助标签的亲和介质将目标蛋白纯化出来,可以不受抗体、物种限制,比较轻松的获得目标蛋白的结合蛋白,还可以通过外源同时表达目标蛋白和待测蛋白,确定它们是否发生直接的相互作用,但该方法无法得知体内真实的结合情况。
酵母双杂交技术是比较古老的一种技术,将目标蛋白和待测蛋白与GAL4 的两个结构域BD和AD融合表达,在酵母细胞中,2个蛋白的结合使得BD和AD在空间上靠近,从而激活报告基因lacZ的表达。但是由于受试蛋白都需要和 AD/BD 结构域形成融合蛋白,空间构象可能改变;另外假阳性率也比较高。
荧光双分子互补(BiFC)技术将目标蛋白和待测蛋白分别与GFP的两个片段融合表达,转染细胞后,2个蛋白的结合使得GFP两个片段空间上靠近,从而发出绿色荧光,该技术观测直观,操作简便,但空间分辨率大约 250nm,对于蛋白质相互作用来说依然是个相当远的距离,因此位置上靠近但并未结合的蛋白也可能显示阳性结果,假阳性率较高;另外该技术可以验证蛋白间的相互作用,但不能筛选未知互作蛋白。
荧光共.技术依靠荧光确定蛋白质具有相同.,用于辅助证明而非直接证明细胞内蛋白间的相互作用。
以上方法通常相互补充,多种方法共同确定蛋白质间的相互作用,也能更大程度的避免假阳性结果。
免疫共沉淀(Co-IP)技术服务案例—客户文章解析

胆固醇通过APMAP抑制EGFR降解诱导前列腺癌细胞转移
研究背景
转移性前列腺癌具有很高的致命性。已有报道表明,胆固醇与前列腺癌的发展有关;前期研究发现,胆固醇可以诱导前列腺癌细胞发生上皮-间质转化(EMT),但其作用及潜在机制尚不清楚。
研究线路
细胞功能实验证实胆醇诱导前列腺癌细胞EMT的发生依赖于ERK1/2的激活RNA-seq、蛋白组学等实验筛选和验证与胆固醇有关的差异基因和蛋白,确定ERK1/2的上游凋节因子“ APMAI和“"EGFR”作为后续研究目标APMAP基因敵除后的RNA-seq结果及其细胞实验均显示APMAP和胆固醇可能有相似的功能APMAP和EGFR的表达关系实验表明 APMAP通过调节EGFR参与胆固醇诱导的EMT过程免疫共沉淀Co-IP结合质谱实验找到 APMAP的互作蛋白EPS15R免疫荧光结果显示胆固醇诱导使EPS15R和APMAP的作用增强,EPS15R与EGFR解离,进而抑制EGFR降解床样本分析APMAP与前列腺癌的关系
研究结论
本研究证明胆固醇介导APMAP上调,APMAP通过与EGFR竞争结合EPS15R,进而抑制EGFR降解,激活ERK1/2通路,促进前列腺癌细胞EMT;提出APMAP可能是一种关键的调节剂,为高脂肪饮食、肥胖和癌症转移之间提供了联系。
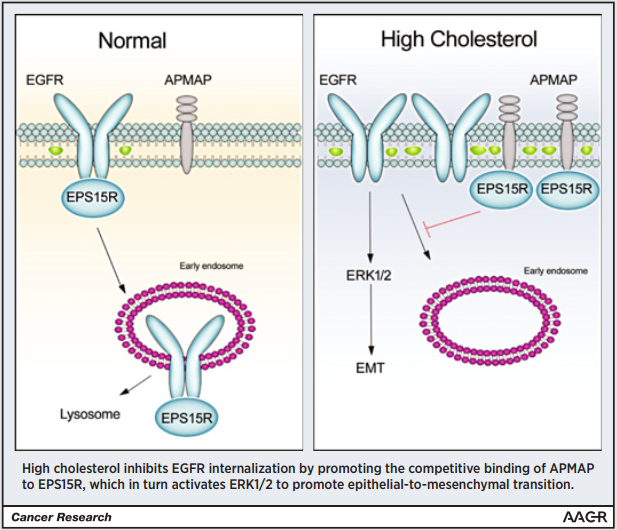
客户文献
Jiang S.Y. et al: Cholesterol Induces Epithelial-to-Mesenchymal Transition of Prostate Cancer Cells by Suppressing Degradation of EGFR through APMAP. Cancer Research. 2019. (IF=12.701).



